Contact:Errol Zhou (M.)
Tél : plus 86-551-65523315
Mobile/WhatsApp : plus 86 17705606359
Q :196299583
Skype :lucytoday@hotmail.com
E-mail:sales@homesunshinepharma.com
Ajouter:1002, Huanmao Bâtiment, N°105, Mengcheng Route, Hefei Ville, 230061, Chine
Immunomedics est un pionnier dans la technologie conjugué de médicaments antibody de nouvelle génération (ADC), qui se consacre à aider les patients atteints de cancer à changer des vies. Le cœur de sa plate-forme exclusive ADC est l’utilisation d’un nouveau type de lien. Ce lien n’a pas besoin d’enzymes pour libérer des charges utiles, et peut fournir des médicaments actifs dans les cellules tumorales et dans le microenvironnement tumoral, résultant en un effet spectateur. ). Récemment, la société a annoncé que la Food and Drug Administration (FDA) des États-Unis a approuvé Trodelvy (sacituzumab govitecan-hziy) pour les adultes atteints d’un cancer du sein métastatique triple négatif (mTNBC) qui ont déjà reçu au moins deux thérapies pour les patients atteints de maladie métastatique. Il est intéressant de mentionner que Trodelvy est le premier médicament ADC approuvé par la FDA pour traiter spécifiquement rechute ou réfractaire mTNBC, et le premier anti-Trop-2 ADC médicament approuvé par la FDA.
TNBC est un cancer agressif avec un mauvais pronostic. En plus de la chimiothérapie traditionnelle, les options de traitement sont extrêmement limitées. Trodelvy a le potentiel de devenir une norme de soins pour le traitement TNBC. Dans les essais cliniques, Trodelvy a montré la remise clinique dans les patients présentant mTNBC réfractaire. Le médicament fournira aux cliniciens un nouvel outil pour améliorer les résultats du traitement pour les patients atteints de la MTNBC. Les analystes de l’industrie ont déjà déclaré que, selon les données cliniques de phase II, Trodelvy représente une amélioration significative par rapport aux soins standard, et les ventes maximales du médicament après qu’il devrait atteindre plus de 1 milliard de dollars.
L’ingrédient pharmaceutique actif de Trodelvy est sacituzumab govitecan, qui est un nouveau et premier médicament conjugué médicament antibody (ADC). Il se compose d’un anticorps IgG1 humanisé ciblant l’antigène TROP-2 et le médicament de chimiothérapie irinotecan (une topologie) Inhibiteur d’Isomerase I) est formé en couplant le produit actif métabolique SN-38. TROP-2 est une glycoprotéine de surface de cellules exprimée dans plus de 90% de TNBC.
Auparavant, la FDA a accordé Trodelvy Breakthrough Drug Qualification (BTD) et l’examen prioritaire. Sur la base du taux de réponse objectif (ORR) et de la durée de réponse (DOR) des données observées dans l’étude multicentenaire de phase II, Trodelvy a été approuvé par un processus d’approbation accéléré. L’approbation continue de cette indication dépendra de la validation et de la description de l’avantage clinique dans l’étude de confirmation de phase III ASCENT (inscription de 500 patients atteints de mTNBC). Tout récemment, sur la base des recommandations du Comité indépendant de surveillance de la sécurité des données (DSMC), l’étude de l’ASCENT a été interrompue tôt en raison des preuves convaincantes d’efficacité sur plusieurs critères d’évaluation, et les données seront publiées au milieu de cette année.
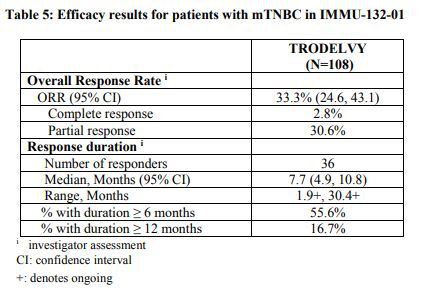
Au total, 108 patients adultes atteints de mTNBC sur-prétraitement ont été inscrits à l’étude multicentère de phase II à bras unique. Ces patients avaient précédemment reçu des thérapies multiples (gamme : 2-10) pour traiter la maladie métastatique. Les données ont montré que le taux de réponse objectif (ORR) du traitement Trodelvy était de 33,3 % (IC à 95 % : 24,6, 43,1), et que la durée médiane de réponse (DOR) était de 7,7 mois (IC à 95 % : 4,9, 10,8).
Un avertissement de boîte noire est fixé à l’étiquette de médicament De Trodelvy, indiquant la neutropénie grave et la diarrhée grave. Les effets indésirables les plus fréquents survenant chez 25 % ou plus de patients comprennent des nausées, une neutropénie, de la diarrhée, de la fatigue, de l’anémie, des vomissements, une perte de cheveux, de la constipation, une perte d’appétit, une éruption cutanée et des douleurs abdominales. Les événements indésirables les plus courants de grade 3 ou 4 qui se produisent dans plus de 5% de patients sont la neutropénie, le leukopenia, l’anémie, l’hypophosphatémie, la diarrhée, la fatigue, la nausée, et le vomissement. 2% des patients ont cessé le traitement en raison d’événements indésirables. Il n’y avait aucun décès lié au traitement ou cas sérieux de neuropathie ou de maladie pulmonaire interstitielle.
Le cancer du sein est le type de cancer le plus courant chez les femmes, avec plus de 2 millions de cas diagnostiqués dans le monde chaque année. Le cancer du sein trois fois négatif (TNBC) représente environ 15 % de tous les cancers du sein. Par rapport à d’autres types de cancer du sein, TNBC est plus fréquent chez les femmes de moins de 50 ans. TNBC se réfère spécifiquement au cancer du sein avec l’expression négative du récepteur d’oestrogène (ER), du récepteur de progestérone (PR) et du récepteur du facteur de croissance épidermique humain 2 (HER-2), qui progresse rapidement et a un pronostic pauvre, 5 ans Le taux de survie est inférieur à 15%. TNBC est inefficace pour l’hormonothérapie et la thérapie ciblée HER2 (comme Herceptin Roche), et les options de traitement clinique sont très limitées, principalement en s’appuyant sur la chimiothérapie.
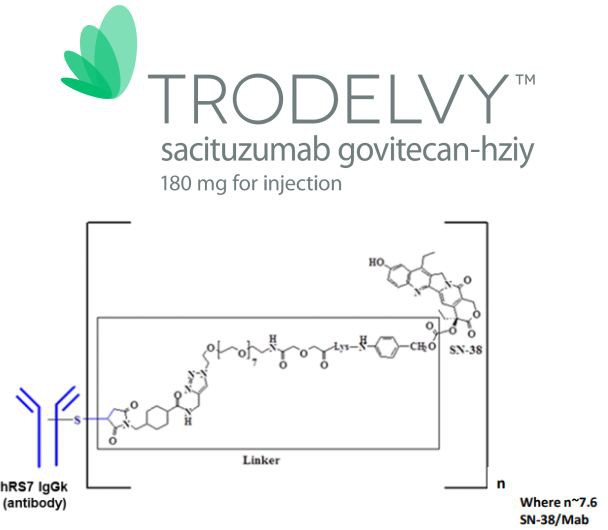
Trodelvy est un nouveau médicament conjugué de premier médicament antibody(ADC), qui se compose du métabolisme de l’anticorps IgG1 humanisé ciblant l’antigène TROP-2 et le médicament de chimiothérapie irinotécan (un inhibiteur de la topoisomérase I) Produit actif SN-38 est couplé. TROP-2 est une glycoprotéine de surface de cellules exprimée dans plus de 90% de TNBC. Actuellement, Immunomedics évalue Trodelvy pour le traitement de divers types de cancer, y compris mTNBC, carcinome urothelial, et non-petites cellules cancer du poumon.
Il convient de mentionner qu’en termes de traitement TNBC, l’immunothérapie de tumeur De Roche PD-L1 Tecentriq a été approuvée par la FDA des USA en mars 2019, et la chimiothérapie combinée (Abraxane) est le traitement de première intention pour le patient positif de CANCER du sein localement avancé ou métastatique triple négatif de PD-L1 (TNBC). Avec cette approbation, la combinaison Tecentriq et Abraxane est devenue le premier traitement d’immunothérapie contre le cancer pour TNBC.
Source:FdaSubventions accéléréesApplicationroval pour Le Trodelvy d’Immunomedics dans le cancer du sein triple négatif métastatique précédemment traité